INTRODUÇÃO
São esperados 704 mil casos de câncer no Brasil no triênio (2023-2025). Os principais tipos de câncer mais incidente entre são: cânceres de mama feminina e próstata representam aproximadamente 15,0% dos casos novos cada um, seguidos do câncer de cólon e reto (9,4%), traqueia, brônquio e pulmão (6,7%), estômago (4,4%) e colo do útero (3,5%) [1].
Com a transição demográfica em curso no Brasil, observa-se um aumento progressivo da expectativa de vida e, consequentemente, uma maior proporção de pessoas idosas em relação aos demais grupos etários. Esse fenômeno tem provocado mudanças significativas no perfil de morbimortalidade do país. No entanto, essa transição ocorre de forma heterogênea entre as regiões, influenciada por desigualdades socioeconômicas, culturais, raciais, níveis de urbanização e acesso aos serviços de saúde.
Paralelamente, a população está exposta cada vez mais a fatores de risco modificáveis, como alimentação inadequada, sedentarismo, excesso de peso, tabagismo e uso abusivo de álcool e outras substâncias. Segundo o Plano de Ações Estratégicas para o Enfrentamento das Doenças Crônicas Não Transmissíveis (2022–2030), somam-se a esses fatores outros elementos relevantes, como a exposição a agentes carcinogênicos ambientais e ocupacionais (por exemplo, poluição do ar, agrotóxicos e substâncias químicas), infecções crônicas por vírus como HPV e hepatites B e C, além de determinantes sociais da saúde, como baixa escolaridade e condições precárias de trabalho e moradia [2].
Todos esses fatores contribuíram para uma transição epidemiológica marcada pelo predomínio das doenças crônicas não transmissíveis (DCNT), entre as quais o câncer ocupa papel de destaque. O impacto do câncer nos sistemas de saúde é expressivo, especialmente em razão dos elevados custos relacionados aos diagnósticos, tratamentos e cuidados de longo prazo [2].
No campo do diagnóstico, a tecnologia contribui para identificação cada vez mais precoce da doença – o que é um dos pilares fundamentais para um tratamento eficaz. Equipamentos de tecnologia avançada se tornam aliados nos exames preventivos como Papanicolau, colposcopia, mamografia e outros, para quem tem suspeita de câncer.
Entre 2023 e 2024, o SUS incorporou um total de 67 novas tecnologias, sendo 16 voltadas exclusivamente para o combate ao câncer [3].
Análise dos gastos oncologia no SUS
Ao analisarmos os dados do DATASUS e do Portal da Transparência da União (https://portaldatransparencia.gov.br/funcoes/10-saude?ano=2022) encontramos um crescimento contínuo e expressivo dos gastos públicos com o tratamento oncológico no Brasil entre os anos de 2020 e 2024. As despesas com procedimentos ambulatoriais (SIA) e hospitalares (SIH), incluindo tratamentos e cirurgias em oncologia, ultrapassaram a marca de R$ 27 bilhões em 2024, representando um incremento substancial em comparação a 2020, quando os valores se situavam em torno de R$ 3,1 bilhões. Esse aumento revela não apenas a ampliação da demanda por assistência oncológica, mas também o impacto progressivo das Doenças Crônicas Não Transmissíveis (DCNT) na estrutura do Sistema Único de Saúde (SUS).
Ao observar a composição desses gastos em 2024, constata-se que aproximadamente 87% dos recursos foram destinados à assistência hospitalar, enquanto 13% corresponderam às despesas ambulatoriais, refletindo a complexidade e o alto custo dos tratamentos oncológicos em regime de internação, como cirurgias, quimioterapias e cuidados intensivos. Do total investido na área da saúde em 2024, as despesas em oncologia representaram cerca de 14%, e quando se considera especificamente a subárea de assistência hospitalar e ambulatorial, esse percentual alcança 32%, evidenciando a centralidade do câncer no orçamento público da saúde.
OBJETIVO
Atualização do estudo que: Identificar os custos diretos do tratamento de primeira linha em relação a cirurgia, quimioterapia (QT), radioterapia (RT) e hormonioterapia para pacientes com Câncer de Mama HER-2 Negativo com Receptor Hormonal Positivo (RH+) (C50); Câncer de Pulmão não pequenas células (C34); Câncer de próstata (C61) e mieloma múltiplo (C90) sob a perspectiva do pagador público, via Sistema Único de Saúde (SUS). Mostrar que o tratamento com cirurgia, QT e RT tem menor custo nos estádios iniciais.
METODOLOGIA
Foi realizada uma pesquisa quantitativa descritiva com dados secundários sobre o custo do tratamento da neoplasia de acordo com a Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde – o CID-10. Esse estudo segue as diretrizes da Lei nº 12.527/2011 e não necessita de aprovação de um Comitê de Ética em Pesquisa na Plataforma Brasil para o seu desenvolvimento por se tratar de um estudo que usa dados secundários obtidos em bases públicas governamentais em sua metodologia.
Foram considerados neste estudo, para análise de custo, câncer de mama (C50) com subtipo receptores de estrogênio e/ou progesterona positivo, com o tratamento hormonal pós e pré menopausa; Câncer de Pulmão não pequenas células (C34); Câncer de próstata (C61) e mieloma múltiplo (C90).
Para as neoplasias sólidas foi calculado o tratamento, segundo os procedimentos cirúrgicos, radioterapia, quimioterapia e hormonioterapia para os estágios clinicopatológicos gerais I,II, III e IV.
Por se tratar de uma neoplasia hematológica, foi considerada, para fins de análise, as diferentes formas de tratamento do mieloma múltiplo. O processo terapêutico tem início a partir do diagnóstico confirmado (por meio de exames específicos de identificação da doença) e segue conforme a elegibilidade do paciente ao transplante de células-tronco hematopoéticas (TCTH). Assim, os pacientes foram classificados em dois grupos:
- Elegíveis ao TCTH com tratamento farmacológico;
- inelegíveis ao TCTH, tratados exclusivamente com quimioterapia.
Os critérios de elegibilidade foram definidos de acordo com as Diretrizes Diagnósticas e Terapêuticas (DDT) [4 ] do Ministério da Saúde.
Considerou-se, para esta neoplasia hematológica, um período de um ano de acompanhamento e tratamento, uma vez que o mieloma múltiplo é uma neoplasia até então incurável, caracterizada por períodos alternados de remissão e recidiva.
O perfil de paciente usado para cálculo das doses das medicações foram:
MAMA: uma mulher adulta, com peso de 70 kg, com idade de 55 anos e altura 1,60m e creatinina de 0,9 mg/dl, consideramos, também, uma superfície corpórea de aproximadamente 1,80 m2.
PULMÃO: O peso utilizado para o cálculo das doses das medicações é de 70kg com superfície corpórea 1,79 m2.
PRÓSTATA: O peso utilizado para o cálculo das doses das medicações foi de ~80 kg, com superfície corpórea 1,9m2.
MIELOMA MÚLTIPLO: O peso utilizado para o cálculo das doses das medicações ~ 65,5kg com superfície corpórea 1,73 m2.
As informações financeiras sobre o tratamento, foram levantadas no ano de 2025 através do SIGTAP Sistema de Gerenciamento da Tabela de Procedimentos, Medicamentos e Órteses, próteses e materiais especiais do Sistema Único de Saúde (SUS) (http://sigtap.datasus.gov.br/tabela-unificada/app/sec/inicio.jsp), bem como a Tabela da Câmara de Regulamentação do Mercado de Medicamentos (CMED) que informa sobre o preço máximo de venda ao governo (PMVG) (https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/cmed/precos) e preços de medicamentos por princípio ativo através da coluna por preço de fábrica (PF), com valores calculados sob a alíquota de Imposto sobre Circulação de Mercadorias e Serviços (ICMS) de 18%. Para realização dos cálculos, utilizou-se a moeda brasileira (R$).
Para a realização deste estudo foi adotada como referência a diretriz de recomendações terapêuticas do protocolo clínico e diretrizes terapêuticas [5-10] do Ministério da Saúde para o câncer de mama, pulmão e próstata, e para mieloma múltiplo foi usada a DDT [4], também, do ministério da saúde. Ambas as recomendações terapêuticas podem sofrer ajustes conforme a conduta médica de cada especialista.
Radioterapia segundo a portaria Nº 263, de 2019 não é mais considerada pelo centigray, mas por pacote de sessões, sendo validade fixa e máxima de 3 (três) meses. Outro ponto foi a atualização de PCDTs conforme os anos e atualizações de protocolos.
A tabulação dos resultados e a análise foram realizados por meio do programa Microsoft Excel.
RESULTADOS
Fonte: própria.
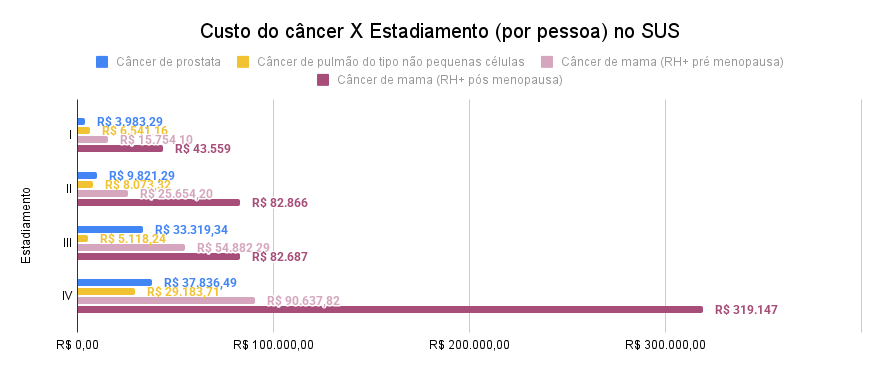
O câncer de próstata apresenta custos crescentes e proporcionais à progressão da doença, mas sem aumentos abruptos. No Estágio I (T1-T2a E Gleason ≤ 6 E PSA < 10ng/ml) a cirurgia custou R$ 3.983,29. Já no Estágio II (T2b-T2c OU Gleason 7 OU PSA 10-20 ng/ml) com inclusão de tratamentos combinados, como cirurgia mais radioterapia apresentou um custo de R$ 9.821,29. Para o Estágio III (Tumor irressecável ou com Linfonodos Positivos) houve uma elevação mais acentuada, indicando protocolos com hormonioterapia (ADT: gosserrelina + bicalutamida) ao tratamento com radioterapia, custando R$ 33.319,34. O Estágio IV custou R$ 37.836,49, possivelmente devido à mudança do enfoque paliativo no SUS, com aumento de ciclo hormonioterápico em fase metastática e radioterapia.
Para o câncer de pulmão de não pequenas células com custos intermediários. No Estágio I considerando o Tumor < 4cm e Linfonodos Negativos, geralmente tratada com cirurgia, e apresentou um custo de R$ 6.541,16. Jana na Estágio II considerando Tumor > 4cm e Linfonodos Negativos houve aumento discreto, refletindo a introdução de quimioterapia adjuvante (cisplatina + etoposide) e tratamento pós medicação com custo de R$8.073,32. No Estágio III com Tumor Irressecável ou com Linfonodos Positivos, houve a redução do valor devido a tratamento paliativo com baixa dose, custando cerca de 5.118,24. O Estágio IV custou R$29.183,71, possivelmente ao acesso a terapias de alto custo em fase metastática.
No câncer de mama RH+ pré menopausa o custo no estágio I considerando cirurgia, radioterapia e hormonal (Tamoxifeno) resultou no custo de R$ 15.754,10. Já o estágio II teve um aumento moderado, refletindo o uso combinado de cirurgia, radioterapia, quimioterapia (TC:docetaxel + ciclofosfamida) e hormonioterapia (Tamoxifeno), custando R$ 25.654,20. Para o custo do tratamento na fase estágio III custo praticamente duplicado, associado a tratamentos sistêmicos prolongados, cirurgia, radioterapia, quimioterapia (AC+T: doxorrubicina+ciclofosfamida+paclitaxel) e hormonal (tamoxifeno) R$ 54.882,29. O estágio IV apresentou um custo de R$ 90.637,82, isso pelo uso de terapias-alvo (anastrazol + análogo de LHRH) e radioterapia paliativa na fase metastática.
Para o câncer de mama RH+ pós menopausa apresentou o maior impacto econômico entre todos os analisados. No estágio I já inicia com custo alto, devido à consideração de um inibidor de aromatase (anastrozol), além de cirurgia, radioterapia, custando R$ 43.559,30. Já para o estágio II com protocolos de combinação terapêutica, com cirurgia, quimioterapia (AC+T: doxorrubicina ciclofosfamida + paclitaxel), radioterapia e Inibidor de aromatase, resultou em R$ 82.866,34 de custo. No estágio III, com custo praticamente estável, indicando continuidade do mesmo protocolo, resultou no custo de R$ 82.687,49. O Estágio IV teve um salto muito expressivo (quase dez vezes maior), relacionado ao uso de medicamentos de alto custo, como terapias-alvo fulvestranto e radioterapia paliativa em fase metastática, custando cerca de R$ 319.147,02.
Já o custo total relacionado ao diagnóstico do mieloma múltiplo foi de R$ 1.842,30, valor correspondente aos procedimentos necessários para confirmação da doença e avaliação do quadro clínico inicial do paciente.

Fonte: própria.
Em relação aos tratamentos farmacológicos, observou-se uma diferença significativa entre os custos de pacientes elegíveis e inelegíveis ao transplante de células-tronco hematopoéticas (TCTH).
Para os pacientes elegíveis ao TCTH, o custo anual total do tratamento foi de R$ 263.696,48, englobando etapas como exames pré-transplante, internação, mobilização de células-tronco, quimioterapia de condicionamento, o próprio transplante e o tratamento de manutenção.
Já para os pacientes inelegíveis ao TCTH, o custo total anual foi de R$ 108.953,70, valor que inclui exames mensais de controle e o esquema quimioterápico baseado em bortezomibe, melfalana e prednisona.
Esses resultados evidenciam que o tratamento de pacientes elegíveis ao TCTH representa a maior parte do custo total, refletindo a complexidade e o caráter intensivo do manejo desses casos.
DISCUSSÃO
Estudos recentes sobre o ônus econômico do câncer revelam que, globalmente, os tipos de neoplasias que mais contribuem para os custos macroeconômicos variam de acordo com o nível de renda e o perfil epidemiológico de cada país 14. De maneira geral, o maior ônus financeiro na maioria das nações — incluindo China e Estados Unidos — decorre dos cânceres de mama, cólon e reto, refletindo tanto sua alta incidência quanto os elevados custos associados ao diagnóstico e tratamento prolongado dessas doenças [11].
Na América Latina, a situação é particularmente desafiadora. A região apresenta uma proporção alarmante de diagnósticos de câncer de mama em estágios avançados [12]. Uma metanálise que incluiu 221.255 mulheres com câncer de mama em 22 países latino-americanos e caribenhos revelou que cerca de 41% dos casos foram diagnosticados nos estágios III ou IV, indicando falhas persistentes na detecção precoce e no acesso oportuno ao tratamento [12]. Esse padrão contribui para o aumento expressivo dos custos diretos e indiretos, já que tratamentos em estágios avançados são mais complexos, onerosos e apresentam menor custo-efetividade. Já no Brasil, o câncer de mama representa o principal contribuinte para o custo macroeconômico, alinhando-se com a alta prevalência e o diagnóstico frequentemente tardio nestes contextos [11].
Estudos internacionais indicam que o transplante autólogo de células-tronco hematopoiéticas (TCTH) apresenta custos iniciais elevados, mas tende a ser uma alternativa custo-efetiva no manejo de pacientes elegíveis. Uma análise baseada em dados de pacientes norte-americanos acima de 65 anos mostrou que o custo médio nos primeiros 100 dias após o transplante foi de aproximadamente US$ 60.000 (cerca de R$ 322.878,00), enquanto a razão incremental de custo-efetividade (ICER) foi estimada em torno de US$ 72.852 (≈ R$ 392.038,47) [13]. De forma semelhante, uma revisão sistemática identificou que, para pacientes elegíveis ao transplante, essa estratégia foi a mais custo-efetiva como tratamento de primeira linha, com ICERs variando entre US$ 3.848 e US$ 72.852 (R$ 20.707,24 – R$ 392.038,47) por ano de vida ganho [14].
Por outro lado, no contexto de pacientes inelegíveis ao transplante, os custos associados ao tratamento tendem a ser mais elevados ao longo do tempo, em razão da necessidade de esquemas prolongados e internações recorrentes. Alguns estudos estimam que o custo de regimes baseados em novos agentes pode ultrapassar US$ 150.000 por QALY (anos de vida ajustados pela qualidade)[14].
Os resultados encontrados neste estudo estão em consonância com essa literatura internacional. Para os pacientes elegíveis ao TCTH, o custo anual total do tratamento foi de R$ 263.696,48, englobando algumas etapas já mencionadas. Já entre os pacientes inelegíveis ao TCTH, o custo anual total foi de R$ 108.953,70. Assim, embora o TCTH represente um investimento inicial maior, seus custos relativos ao longo do tempo e sua melhor relação custo-efetividade reforçam sua importância como estratégia terapêutica para pacientes elegíveis [15,16].
Embora tenham sido realizadas análises de exames de avaliação e monitoramento, optou-se por não incluí-las neste estudo a fim de manter a comparabilidade com a metodologia de 2016.
CONCLUSÃO
Em síntese, tanto no mieloma múltiplo quanto em outros tipos de câncer, a análise de custos evidencia um cenário de crescente complexidade terapêutica e desigualdade nos gastos. Nesse contexto, compreender a evolução dos investimentos públicos em oncologia torna-se fundamental para o planejamento de políticas capazes de assegurar o acesso integral e a qualidade do cuidado à população.
Com a implementação da Política Nacional de Prevenção e Controle do Câncer (PNPCC), aliada à Portaria da Assistência Farmacêutica em Oncologia (AF-ONCO nº 8.477, de 20 de outubro de 2025), espera-se que, futuramente, ocorram transformações significativas nesse panorama de custos. Essas medidas representam avanços estruturais importantes, que trazem perspectivas positivas para a superação de alguns dos desafios hoje identificados na gestão do cuidado oncológico.
Dessa forma, reiteramos a necessidade de fortalecer políticas voltadas à prevenção, ao diagnóstico precoce (certos casos) e à promoção da saúde, especialmente diante do envelhecimento populacional e da persistência de fatores de risco como o tabagismo, a má alimentação e o sedentarismo. Além disso, é essencial ampliar o acesso à pesquisa clínica, que pode representar uma estratégia promissora para mitigar pressões sobre o sistema de saúde e possibilitar o acesso a terapias inovadoras, sobretudo para populações em situação de maior vulnerabilidade.
LIMITAÇÕES
Este estudo apresenta algumas limitações que devem ser consideradas na interpretação dos resultados.
A primeira refere-se à utilização de dados secundários relativos ao financiamento da produção no Sistema Único de Saúde (SUS), os quais podem apresentar divergências entre os dados consolidados e a realidade empírica.
A segunda limitação diz respeito a variabilidade na trajetória individual dos pacientes e nas condições de acesso aos serviços de saúde, o que pode influenciar os custos, tornando-os superiores ou inferiores dependendo do grau de acessibilidade de cada indivíduo e protocolos de tratamentos adotados.
REFERÊNCIAS
- BRASIL. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estimativa 2023: incidência de câncer no Brasil. São Paulo: INCA; 2023. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//estimativa-2023.pdf. Acesso em: [23 de out. 2025].
- BRASIL. Ministério da Saúde. Plano de Ações Estratégicas para o Enfrentamento das Doenças Crônicas e Agravos Não Transmissíveis no Brasil, 2021-2030 (Plano de DANT). Brasília: Ministério da Saúde; 2021. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/doencas-cronicas-nao-transmissiveis-dcnt/09-plano-de-dant-2022_2030.pdf/. Acesso em:Acesso em: [23 de out. 2025].
- BRASIL. Ministério da Saúde. “Inovações tecnológicas e novo protocolo de tratamento reforçam o combate ao câncer”. Brasília: Ministério da Saúde; 10 dez. 2024. Disponível em: https://www.gov.br/saude/pt-br/assuntos/noticias/2024/dezembro/inovacoes-tecnologicas-e-novo-protocolo-de-tratamento-reforcam-o-combate-ao-cancer. Acesso em: [23 de out. 2025].
- BRASIL. Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC). Resumo – Diretriz de Diagnóstico e Tratamento: Mieloma Múltiplo. Brasília: CONITEC; 2023. Disponível em: https://www.gov.br/conitec/pt-br/midias/protocolos/resumidos/DDTResumidoMielomaMltiplo.pdf. Acesso em: 23 out. 2025.
- BRASIL. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas: Adenocarcinoma de Próstata. Brasília: Ministério da Saúde, 2022. Disponível em: https://www.gov.br/saude/pt-br/assuntos/pcdt/a/adenocarcinoma-prostata.pdf/view. Acesso em: 21 out. 2025.
- BRASIL. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas: Câncer de Pulmão. Brasília: Ministério da Saúde, 2022. Disponível em: https://www.gov.br/saude/pt-br/assuntos/pcdt/c/cancer-de-pulmao/view. Acesso em: 21 out. 2025.
- BRASIL. Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC). Relatório de recomendação: Pembrolizumabe para câncer de pulmão de não pequenas células (CNP). Brasília: CONITEC, 2023. Disponível em: https://www.gov.br/conitec/pt-br/midias/relatorios/2023/20231227_pembrolizumabe_859_cancer_pulmao_cnp.pdf. Acesso em: 21 out. 2025.
- BRASIL. Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC). Relatório de recomendação preliminar: Câncer de Mama. Brasília: CONITEC, 2024. Disponível em: https://www.gov.br/conitec/pt-br/midias/consultas/relatorios/2024/RRPCDTCncerdeMama_CP.pdf. Acesso em: 21 out. 2025.
- BRASIL. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Manual de Oncologia – 29ª edição. Rio de Janeiro: INCA, jun. 2022. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/manual_oncologia_29a_edicao_-_junho_2022.pdf. Acesso em: 21 out. 2025.
- BRASIL. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Protocolo unificado: neoplasias malignas não hematológicas. Rio de Janeiro: INCA, fev. 2022. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/protocolo_unificado_neoplasias_malignas_nao_hematologicas_fevereiro_2022.pdf. Acesso em: 21 out. 2025.
- CHEN, S. et al. Estimates and Projections of the Global Economic Cost of 29 Cancers (2020–2050). JAMA Oncology, v. 9, n. 5, p. 667–678, 2023. DOI: 10.1001/jamaoncol.2023.0213. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC9951101/. Acesso em: 30 out. 2025.
- CASTILLO-LABORDE, C. et al. Cancer Clinical Trials and Access to Innovative Treatments in Latin America: Challenges and Opportunities. The Lancet Regional Health – Americas, v. 30, 100779, 2024. DOI: 10.1016/j.lana.2024.100779. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC12205613/. Acesso em: 30 out. 2025.
- Shah, G. L.; Winn, A. N.; Lin, P.-J.; Klein, A.; Sprague, K. A.; Smith, H. P.; Buchsbaum, R.; Cohen, J. T.; Miller, K. B.; Comenzo, R.; Parsons, S. K. Cost-Effectiveness of Autologous Hematopoietic Stem Cell Transplantation for Elderly Patients with Multiple Myeloma using the Surveillance, Epidemiology, and End Results-Medicare Database. Biology of Blood and Marrow Transplantation. 2015 Oct; 21(10):1823-1829. doi:10.1016/j.bbmt.2015.05.013.
- CAO, Yaohua; ZHAO, Lina; ZHANG, Tiantian; CAO, Weiling. Cost-Effectiveness Analysis of Adding Daratumumab to Bortezomib, Melphalan, and Prednisone for Untreated Multiple Myeloma. Frontiers in Pharmacology, 2021. Disponível em: https://www.frontiersin.org/journals/pharmacology/articles/10.3389/fphar.2021.608685/full?. Acesso em: 23 out. 2025.
- FU, Shuangshuang; WU, Chi-Fang; WANG, Michael; LAIRSON, David R. Cost Effectiveness of Transplant, Conventional Chemotherapy, and Novel Agents in Multiple Myeloma: A Systematic Review. Pharmacoeconomics, 2019 Dec; 37(12):1421–1449. doi: 10.1007/s40273-019-00828-y. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31392666/. Acesso em: 23 out. 2025.
- HAOUATTI, Fairouz; BELHADJ, Ikram K.; GOUMIDI, Ahlem; YAFOUR, Nabil; TOUMI, Houari. The cost of multiple myeloma and its complications. Em-consulte, [s.d.]. Disponível em: https://www.em-consulte.com/article/1670297/the-cost-of-multiple-myeloma-and-its-complications?. Acesso em: 23 out. 2025.
Estudo anterior:
2016
Realização: